Усовершенствованная визуализация, которая отражает нейронную активность и нейрохимию у людей и экспериментальных животных, позволяет нам получить четкое представление о мезомасштабных изменениях в мозге, имеющих большое значение для развития зависимостей.
Раннее внедрение исследователями зависимости оптогенетических и хемогенетических подходов обеспечило элегантную поддержку и уточнение гипотез о роли конкретных цепей в поведении и физиологии, связанных с зависимостью.
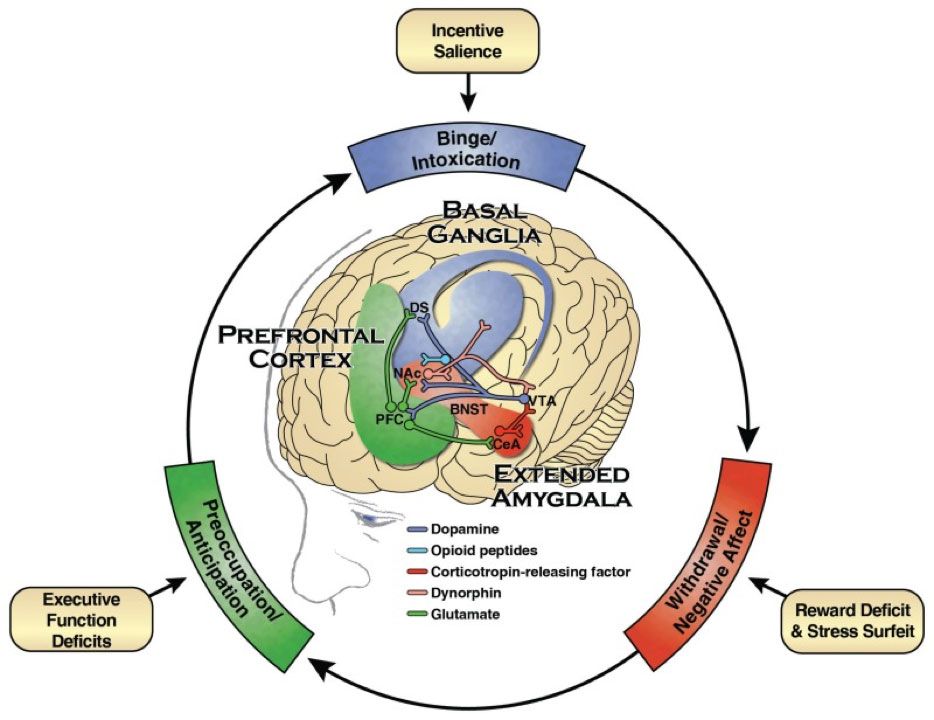
Значительный прогресс в нейробиологии зависимости можно объяснить эвристической трехэтапной моделью цикла зависимости: переедание/интоксикация, абстинентный синдром/негативные эмоции и озабоченность/предвкушение. Эта модель подтверждается многочисленными нейроадаптациями в трех соответствующих областях:
- Повышенная привлекательность стимула
- Снижение мозговой активности, связанной с вознаграждением, и повышение уровня стресса
- Нарушение исполнительных функций
Эти изменения происходят в трех основных нейронных сетях: базальных ганглиях, расширенной миндалевидной железе и префронтальной коре (рис. 1).
В нейробиологии зависимости акцент сместился с механизмов острого удовольствия на стадии запоя/опьянения на нейроадаптацию, возникающую в результате воздействия наркотиков. К ним относятся механизмы, определяющие привлекательность стимулов, компульсивные привычки, дефицит удовольствия и стресс на стадии абстиненции/негативного аффекта, а также модуляция исполнительных функций и мнемонических систем (и их модуляция мнемоническими процессами) на стадиях озабоченности/ожидания при расстройствах, связанных с употреблением психоактивных веществ.
Какая часть мозга вызывает зависимость?
За зависимость не отвечает какая-то конкретная часть мозга. В этом сложном органе есть несколько областей и нейромедиаторов, которые работают сообща. При злоупотреблении наркотиками или алкоголем эти сложные механизмы выходят из равновесия. На каждом этапе процесса зависимости нарушаются функции разных частей мозга, и это играет роль как в возникновении зависимости, так и в её развитии.
Во главе списка стоит мезолимбическая дофаминовая система, или система вознаграждения в мозге. Эта ключевая область — часть мозга, которая доставляет нам удовольствие. После многих лет злоупотребления психоактивными веществами мозг теряет чувствительность к таким веществам, как опиоиды, кокаин и алкоголь, что приводит к повышенному высвобождению дофамина, который может усиливать компульсивное поведение.
В рамках этой сети структур мозга миндалевидное тело играет ключевую роль в вознаграждении, мотивации и обработке эмоций. Нарушения в регуляции гормонов стресса могут усиливать беспокойство и усиливать реакцию человека на стрессовые ситуации. Стресс и тревога также являются распространенными триггерами для людей, страдающих от злоупотребления психоактивными веществами.
Обычно мы можем поблагодарить нашу префронтальную кору за то, что она помогает нам принимать рациональные решения, контролировать импульсы и регулировать эмоции. С другой стороны, у зависимых людей мозг структурно повреждён, что может приводить к усилению тяги, склонности к риску и, в конечном счёте, к рецидиву.
Недалеко от центра мозга, базальных ганглиев, расположена группа структур, которые играют роль в поведении, связанном с поиском наркотиков, и формировании привычки. Эти взаимосвязанные области мозга участвуют в контроле движений, вознаграждении, обработке информации и обучении. Повреждение этой области является причиной того, что у страдающих алкоголизмом людей может наблюдаться нетвердая походка.
Это лишь несколько областей мозга, которые участвуют в формировании зависимости. У всех последствия будут разными. Психологам и психиатрам важно понимать, как они взаимодействуют друг с другом, чтобы обеспечить человеку наиболее подходящее лечение.
Роль нейромедиаторов в зависимости
1. Дофамин: центральный игрок в путях вознаграждения
Дофамин часто называют основным нейромедиатором, участвующим в системе вознаграждения мозга. Он высвобождается во время приятных занятий, включая употребление наркотиков, что усиливает поведение, связанное с этими действиями. Когда наркотики употребляются, они могут вызвать значительное повышение уровня дофамина в ключевых областях мозга, таких как прилежащее ядро (NAcc) и вентральная тегментальная область (VTA). Этот всплеск не только вызывает чувство эйфории, но и усиливает связь между употреблением наркотиков и удовольствием, делая людей более склонными к повторению такого поведения.
Роль дофамина выходит за рамки простого удовольствия; Он также участвует в мотивации и обучении с подкреплением. Выброс дофамина сигнализирует о том, что произошло важное событие, побуждая людей снова искать подобные переживания. Со временем повторное употребление наркотиков может привести к изменениям плотности и функции дофаминовых рецепторов, способствуя толерантности и зависимости.
2. ГАМК: тормозящий модулятор
Гамма-аминомасляная кислота (ГАМК) является еще одним важным нейромедиатором, который играет тормозящую роль в мозге. Он помогает регулировать возбудимость нейронов по всей нервной системе. С точки зрения зависимости, ГАМКергические пути могут влиять на функционирование других нейротрансмиттерных систем, особенно тех, которые связаны с вознаграждением.
Например, алкоголь усиливает активность ГАМК, что приводит к усилению торможения нейронов в цепях вознаграждения. Эта модуляция может способствовать как усиливающему эффекту алкоголя, так и симптомам абстиненции, когда употребление прекращается. В результате люди могут продолжать употреблять такие вещества, как алкоголь, чтобы избежать неприятных состояний отмены.
3. Опиоиды: натуральные обезболивающие средства с потенциалом привыкания
Эндогенные опиоиды (такие как эндорфины) представляют собой природные пептиды, которые связываются с опиоидными рецепторами в мозге и играют важную роль в облегчении боли и ощущении удовольствия. Наркотики, такие как морфин или героин, имитируют эти природные опиоиды, активируя аналогичные рецепторы, что приводит к сильному чувству эйфории.
Взаимодействие между опиоидами и дофаминергическими путями еще больше подчеркивает их роль в зависимости. Увеличивая высвобождение дофамина за счет их действия на нейроны ГАМК в ВТА, опиоиды эффективно увеличивают приятные ощущения, связанные с употреблением наркотиков, одновременно создавая риск зависимости из-за их мощных эйфорических эффектов.
4. Серотонин: регуляция настроения и импульсивность
Серотонин является еще одним важным нейромедиатором, который влияет на регуляцию настроения и импульсивность — факторы, тесно связанные с аддиктивным поведением. Изменения уровня серотонина наблюдались у людей с расстройствами, связанными с употреблением психоактивных веществ; Низкий уровень серотонина может привести к повышенной импульсивности и рискованному поведению, связанному с употреблением наркотиков.
Кроме того, некоторые фармакотерапии для лечения зависимости нацелены на рецепторы серотонина как средство уменьшения тяги к еде или симптомов отмены путем стабилизации настроения и снижения импульсивного поведения, связанного с поиском психоактивных веществ.
5. Норадреналин: реакция на стресс и уязвимость к зависимости
Норадреналин играет жизненно важную роль в реакциях на стресс и состояниях возбуждения в организме. Хронический стресс может изменить сигнальные пути норадреналина, что может повысить уязвимость к употреблению психоактивных веществ, поскольку люди ищут облегчения от дискомфорта, вызванного стрессом, с помощью наркотиков или алкоголя.
Более того, такие наркотики, как кокаин, повышают уровень норадреналина наряду с высвобождением дофамина, способствуя дальнейшему развитию их аддиктивного потенциала, усиливая состояния возбуждения, связанные с поведением, связанным с поиском наркотиков.
Генетические факторы зависимости
Генетическая предрасположенность играет значительную роль в уязвимости человека к зависимости. Исследования близнецов показали, что наследственные генетические компоненты вносят примерно 20-50% в дисперсию развития наркотической зависимости. Были выявлены специфические гены, которые влияют на восприимчивость к различным веществам. Например, вариации в гене транспортера серотонина (SLC6A4) были связаны с повышенным риском злоупотребления психоактивными веществами, особенно такими наркотиками, как кокаин и экстази.
Более того, определенные полиморфизмы в генах, связанных с нейротрансмиттерными системами (такими как дофаминовые и опиоидные рецепторы), могут влиять на реакцию людей на наркотики и вероятность развития у них аддиктивного поведения. Эти генетические факторы взаимодействуют с влиянием окружающей среды, предполагая, что и природа, и воспитание имеют важное значение для понимания зависимости.
Эпигенетические механизмы зависимости
Эпигенетика относится к наследственным изменениям в экспрессии генов, которые не связаны с изменениями в самой последовательности ДНК. На эти изменения могут влиять факторы окружающей среды, такие как воздействие наркотиков, стресс и образ жизни. Ключевые эпигенетические механизмы включают метилирование ДНК и модификации гистонов.
- Метилирование ДНК: Этот процесс включает в себя добавление метильной группы к основаниям цитозина в ДНК, что обычно приводит к подавлению генов. В контексте зависимости наркотики могут вызывать изменения в паттернах метилирования ДНК, которые влияют на экспрессию генов, участвующих в путях вознаграждения и стрессовых реакциях.
- Модификации гистонов: Гистоны — это белки, вокруг которых оборачивается ДНК; Их химические модификации могут изменить структуру хроматина и доступность генов для транскрипции. Например, ацетилирование гистонов обычно способствует экспрессии генов за счет ослабления структуры хроматина, в то время как деацетилирование приводит к подавлению активности генов.
Исследования показали, что хроническое воздействие наркотиков, таких как кокаин или опиоиды, приводит к специфическим эпигенетическим изменениям в областях мозга, связанных с обработкой вознаграждения (например, прилежащее ядро). Эти изменения могут привести к долгосрочным изменениям в поведении и работе мозга, которые характеризуют зависимость.